平台法在生物制剂杂质检测中的应用
生物制药产品的关键质量属性(cqa)在整个生产过程的开发和监管申报过程中被监控。
根据美国食品和药物管理局(FDA)的定义,关键质量属性是“一种属性或特征,应该在适当的限制、范围或分布范围内,以确保所需的药物质量/安全。”为了保证所需的产品质量,已被确定为cqa的杂质应在适当的限制、范围或分布范围内。
生物制品杂质的定义
杂质可以被鉴定、部分表征或结构已知。国际协调理事会(ICH)在Q6B指南、生物技术/生物产品测试程序和验收标准中对生物产品杂质的定义如下:
产品相关杂质
与产品相关的杂质(例如前体或某些降解产物)是在制造和/或储存过程中产生的分子或翻译后的变体,在活性、功效或安全性方面不具有与所需产品相比的特性。
流程相关杂质
如ICH Q6B指南所述,生物制剂中与工艺相关的杂质来自于生产过程,包括:
- 细胞底物(例如,宿主细胞DNA或宿主细胞蛋白质);
- 细胞培养(如培养基组分、诱导剂或抗生素)和/或
- 下游加工成分(例如,生物加工酶、配体、化学和生化加工试剂、载体、无机盐、溶剂和可浸出物)。
虽然与工艺相关的杂质可能对产品的稳定性、安全性或有效性构成直接风险,包括免疫原性或临床安全风险,但应该注意的是,即使所称杂质对患者安全不构成直接风险,杂质仍可能以某种方式影响生物产品的安全性或有效性。
生物制品杂质的评价、控制和监测
设计控制策略以减少或去除最终生物制品中的杂质的关键第一步是对生物制品中存在的杂质建立清晰的认识。除了开发和验证有效和可靠的测试方法来监视和控制杂质,开发、小规模和验证研究不仅必须正确地代表生产过程,而且还必须模拟清除杂质的最坏情况。
在制定控制大分子药物杂质的策略时,作为真正的咨询伙伴的有经验的合同开发和生产组织(CDMO)可能是无价的资源。除了为方法的检测验证标准提供输入和指导外,咨询型CDMO合作伙伴还可以帮助确定和计划需要哪些检测方法,以及在药物开发生命周期中的哪些点需要这些检测方法。188金宝搏手机端Element拥有技术能力、科学专业知识和监管知识,以支持在整个开发过程中评估和控制生物制品中杂质所需的分析测试。我们的咨询专家、专家科学家在整个药物开发生命周期中都是真正的合作伙伴,与客户一起工作,提供相适应的解决方案,以满足他们的大分子疗法的特定需求。
平台分析和方法的成功和好处
为了满足监管预期和积极的开发时间表,关键是要快速获得评估生物制剂质量的方法。此外,对于某些生物模式,如基因和细胞疗法,定量产品和过程杂质的标准测定正变得越来越标准化。平台分析和方法提供了许多好处,包括加快时间线和降低成本。现有的健壮平台方法已经被开发用于Element中广泛的矩阵范围。188金宝搏手机端因此,如果需要的话,很有可能使用Element现有的平台方法进行最小的修改和产品特定验证,从而对整个生物产品管道进行分析。188金宝搏手机端
确定平台方法是否适合你的生物制剂
虽然平台方法是一个强大的工具,可以在整个生物制品生命周期中使用,但平台方法在加速方法开发和验证方面特别有效,可用于药物产品的人体临床试验的发布。在知道需要评估的杂质之后,可以审查现有的方法,以确定使用平台方法是否是适当的方法,如图1所示。
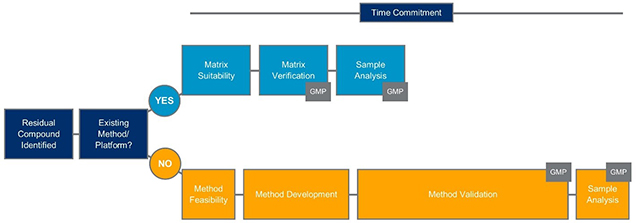
图1。生物产品平台方法决策树
如果平台法可用于所涉杂质,则将进行基质适宜性,以建立生物过程的任何给定阶段对原料药特定的分析条件。与在没有平台方法的情况下为CQA开发一种新方法所需的时间相比,执行矩阵适用性测试的时间承诺要短得多。如果需要,根据程序的阶段适当性,将执行矩阵验证或验证,以建立针对手头样品类型和特定产品的符合cgmp的方法。在基质适宜性(非gmp)或验证(符合cgmp)之后,根据产品生命周期的阶段,可以进行样品分析。如图1所示,当使用平台方法作为起点时,时间承诺将显著减少。
188金宝搏手机端Element对许多常见的与工艺相关的杂质(如卡那霉素、链霉素、IPTG、谷胱甘肽等)有许多已建立的方法。和专家联系了解更多。
找到与你相关的文章核