药物开发中利用生物标志物的调控途径
生物标志物对整个药物开发生命周期至关重要,因为除了加快上市时间外,它们还可以提高药物开发项目的成功率。
生物标记物可用于广泛的目的,包括监测药物或治疗的安全性,并确定治疗是否达到预期的结果。此外,通过从安全性或有效性的角度预测哪些患者对药物的反应更有利,生物标记物有可能在临床试验期间降低成本和节省时间。

图1。生物标志物在整个药物开发生命周期中的作用
药物开发中生物标志物整合的调控途径
美国食品药品监督管理局(FDA)概述了生物标志物证据的三个主要来源,包括科学界共识、药物特异性开发和批准流程以及生物标志物鉴定计划(图2)。尽管每种途径都有其自身的优势和局限性,但生物标志物应根据下面详细介绍的途径仔细评估,因为某些生物标志物更适合特定的途径。
科学界共识
已发表的科学文献为在药物开发过程中使用特定生物标志物的假设提供了基础。追求科学界共识的监管途径的药物开发人员依赖于现有的、已发表的数据,这些数据已告知科学界共识,并已由多个利益相关者仔细审查和审查。这种广泛的回顾和评估可以导致对生物过程或疾病的更好理解。然而,仅依靠科学文献来确定生物标志物的临床用途的药物开发人员可能会面临挑战,因为科学文献中的研究往往是不同目标的产物,这在关联和比较多个出版物的信息时可能会导致并发症和挑战。
特定药物的开发和批准过程
当为特定的研究性新药(IND)或生物项目开发生物标志物时,鼓励药物开发人员利用药物特异性开发和批准流程。虽然药物特异性开发和批准过程监管途径预计将用于实现生物标志物用于特定候选药物的监管接受,但如果能够证明生物标志物适合更广泛的应用,其他药物开发人员或制药公司可以利用为任何特定药物项目提供的信息。
生物标志物鉴定计划
生物标志物可以通过药物评估和研究中心(CDER)的生物标志物鉴定计划获得资格。CDER的生物标记物鉴定计划负责对特定使用环境下的生物标记物进行鉴定,一旦合格,这些生物标记物就可以公开获得,并可以应用于任何使用环境(COU)合适的药物开发项目。在这些情况下,不需要再次检查信息。生物标记物鉴定计划的目的是建立用于特定COU药物开发的生物标记物的价值。FDA将使用背景定义为生物标志物在药物开发中的指定用途的简明描述,包括两个部分,BEST生物标志物类别和生物标志物在药物开发中的预期用途。单个COU应与每个生物标志物鉴定工作相关联。
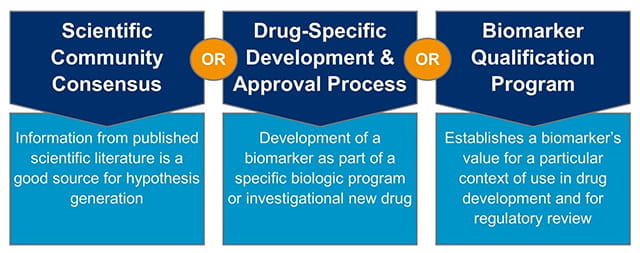
图2。在药物开发中纳入生物标志物的调控途径
为你的生物标志物确定正确的调控途径
在药物开发的早期阶段,药物开发人员可能很难确定哪种调控途径最适合特定的生物标志物。在这些情况下,FDA鼓励药物开发人员考虑几个因素,包括在药物开发中使用生物标志物的原因和环境,可用的资源,生物标志物的类型,以及与他人合作和合作的机会。18bet手机由于生物标志物的开发是一项自愿活动,无论药物开发人员是单一公司还是联盟,监管途径的选择始终由药物开发人员自行决定。
生物标志物鉴定的考虑
当生物标记物提交CDER进行鉴定时,需要明确定义生物标记物的使用上下文(COU)。例如,通过富集生物标记物,可以实现临床试验的靶向患者选择,从而确定候选药物可能具有最显著效果的患者群体。另一个使用上下文的例子是替代端点生物标记物,在临床试验中用作端点,以确定药物是否有效,以及患者是否正在经历预期的治疗效果。
对于提交CDER的所有生物标志物,生物标志物鉴定所需的证据并不统一或标准;相反,证据标准取决于对患者的潜在影响。不同类型的生物标记物的证据标准不同,当生物标记物正确的风险极高,错误预测的后果非常严重时,证据标准的门槛更大。然而,无论使用环境如何,生物标记物鉴定的一些通用标准是存在的,包括稳健分析效度(图3)。
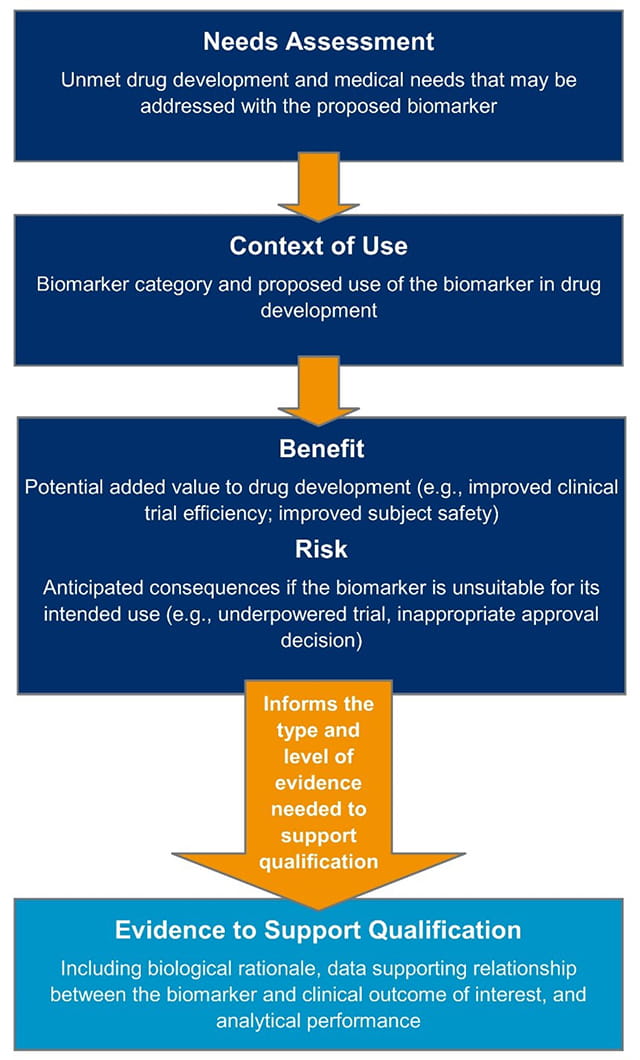
图3。生物标志物鉴定的证据框架
与CRO/CDMO合作,支持生物标志物在药物开发中的使用
选择合适的合同研究组织(CRO)或合同开发生产组织(CDMO)合作伙伴,在整个药物开发生命周期中为您的生物标志物提供生物分析支持与选择正确的监管途径同样重要。合适的CRO/CDMO合作伙伴可以帮助您的组织确保符合监管要求,以获得在整个药物开发生命周期中使用特定生物标志物的批准。
188金宝搏手机端Element的咨询专家科学家团队随时准备支持药物开发,从发现到临床试验及后续工作。我们灵活的团队可以满足您所需的周转时间,在紧迫的时间内提供高质量的结果,我们敬业的项目经理团队促进客户和科学家之间一致、开放的沟通。
找到相关的18bet手机